
科目: 来源: 题型:解答题
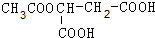 +H2O.
+H2O.
查看答案和解析>>
科目: 来源: 题型:解答题
 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | 白色沉淀 | 除尽Ag+ |
| (2)取少量上层清液于试管中,加入取少量上述溶液于试管中加入 KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上层清液于试管中,加入加入 酸性KMnO4溶液,振荡 | 紫红色消失 | 存在Fe2+ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.
工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题:
SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
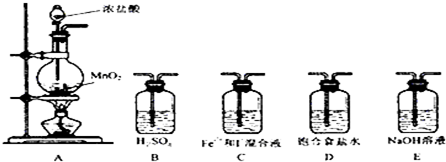
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com