
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
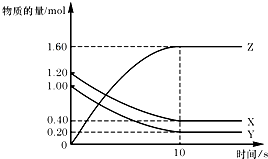 T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 平衡时X、Y的转化率相同 | |
| B. | 达到平衡后,将容器体积压缩为1L,平衡向正反应方向移动 | |
| C. | T℃时,该反应的化学方程式为:X(g)+Y(g)?2Z(g),平衡常数K=40 | |
| D. | T℃时,若起始时X为0.71mol,Y为1.00mol,则平衡时Y的转化率为60% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H=-192.9 kJ•mol-1,则CH3OH的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g);△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2800 kJ•mol-1,则1/2 C6H12O6 (s)+3O2 (g)═3CO2 (g)+3H2O ( l );△H=-1400 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.3mol/(L•s) | C. | v(C)=0.3mol/(L•s) | D. | v(D)=1mol/(L•s) |
查看答案和解析>>
科目: 来源: 题型:解答题
 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.| 实 验 | 实验现象 | 结 论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞溶液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3,而不是NaOH |
| 实验三:取少量反应后的固体产物溶于水,加入足量稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com