
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸钠(aq) | B. | 硝酸钾(aq) | C. | 醋酸钠(s) | D. | 水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入水时,溶液中c(H+) 和c(OH-) 都减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe粉加入稀盐酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 金属钠投到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 石灰石投入到稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钠溶液加入到稀硫酸中:OH-+H+═H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 产生白色沉淀,继而沉淀溶解 | B. | 只放出气体 | ||
| C. | 生成白色沉淀,且不消失 | D. | 既生成白色沉淀又放出气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
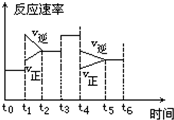 在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:
在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:查看答案和解析>>
科目: 来源: 题型:选择题
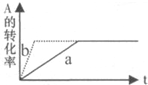
| A. | 若温度不变,将容器的体积缩小1倍,此时A的浓度变为原来的1.8倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时A,B的物质的量之比为m:n | |
| C. | 若平衡体系共有气体amol,再向其中加人bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q | |
| D. | 加催化剂或增大压强,可实现如图a→b的变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 | |
| B. | 甲烧杯中的酸过量 | |
| C. | 两烧杯中参加反应的锌不等量 | |
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 在温度、体积不变的情况下,若按照起始充入比例再向容器中充入反应物,重新达平衡后,HCl的体积分数不变 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com