
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:填空题

 Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).查看答案和解析>>
科目: 来源: 题型:解答题
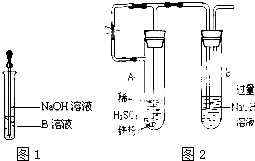 某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com