
科目: 来源: 题型:选择题
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 可用蘸浓硝酸的玻璃棒检验氨气是否已收集满 | |
| C. | 碘是人体必须微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成 |
查看答案和解析>>
科目: 来源: 题型:填空题
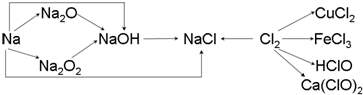
查看答案和解析>>
科目: 来源: 题型:填空题
 +CaCl2+H2O
+CaCl2+H2O
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不管什么反应使用催化剂,都可以加快反应速率 | |
| B. | 可逆反应A(g)?B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大 | |
| C. | 对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 | |
| D. | 参加反应的物质的性质是决定化学反应速率的主要因素 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将一小段用砂纸打磨后的镁带,放入试管中,加入少量水,加热至水沸腾,再向试管中滴加酚酞溶液 3将一小段镁带投入稀盐酸中 4将一小片铝投入稀盐酸中. |
| 实验现象 | A剧烈反应,迅速生成大量的气体 B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C反应不剧烈,产生无色气体 D有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
查看答案和解析>>
科目: 来源: 题型:解答题
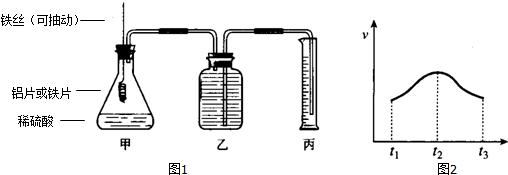
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验 | 1、将一小块金属钠放入滴有酚酞溶液的冷水中. 2、将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. 3、将一小段镁带投入稀盐酸中. 4、将一小片铝投入稀盐酸中. |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com