
科目: 来源: 题型:填空题
 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲认为上述发现绝对不可能,因为H3分子违背了共价键理论 | |
| B. | 丁认为如果上述的发现存在,则证明传统的价键理论并不完善 | |
| C. | 丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+ | |
| D. | 乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体 |
查看答案和解析>>
科目: 来源: 题型:解答题
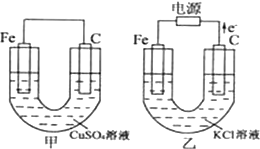 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
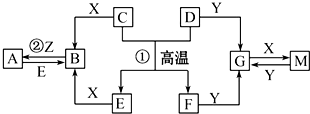
查看答案和解析>>
科目: 来源: 题型:解答题
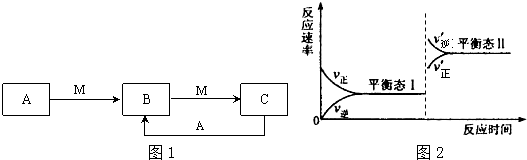
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com