
科目: 来源: 题型:解答题

 .
. .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH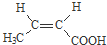 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
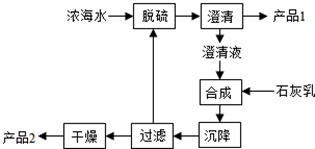
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
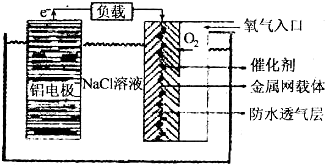
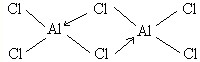 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不同化学反应的限度都相同 | |
| B. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| C. | 当一个可逆反应在一定条件下达到限度时,反应即停止 | |
| D. | 当一个可逆反应在一定条件下达到限度时,正反应速率与逆反应速率相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
查看答案和解析>>
科目: 来源: 题型:解答题
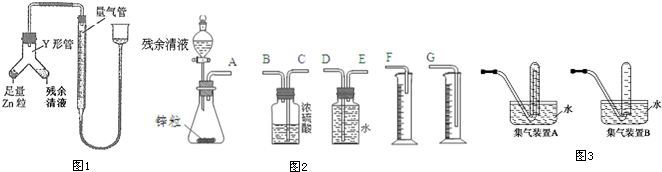
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com