
科目: 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内消耗a mol A的同时消耗a mol B | |
| D. | A、B、C的物质的量之比为1:1:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 绝热容器,温度不再改变 | |
| B. | 恒容时,压强不在改变 | |
| C. | 恒压时,体积不在改变 | |
| D. | 断裂2 mol O-H键同时形成1molH-H键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A. | 反应开始时,反应速率:甲<乙<丙 | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,c(CO2)丙=2c(CO2)甲 | |
| D. | 平衡时,乙中CO2的体积分数大于60% |
查看答案和解析>>
科目: 来源: 题型:解答题
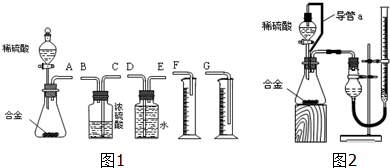
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(OH-)>c(H+)>c(B+)>c(A-) | B. | c(B+)>c(A-)>c(H+)>c(OH-) | ||
| C. | c(B+)>c(A-)>c(OH-)>c(H+) | D. | c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
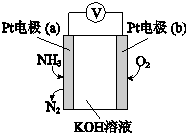
| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极b移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 转移溶液时使用的烧杯未洗涤 | |
| B. | 定容时仰视读取刻度线 | |
| C. | 原容量瓶洗净后有少量蒸馏水 | |
| D. | 固体溶解后立即转移到容量瓶内,定容 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 配制100 mL 1.0 mol/L CuSO4溶液 | 将25 g CuSO4•5H20溶于100 mL蒸馏水中 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的浓溶液,冷却结晶,过滤、洗涤 |
| C | 检验某溶液中是否含硫酸根 | 向溶液中先加盐酸后加氯化钡 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com