
科目: 来源: 题型:选择题
 如图把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.某实验兴趣小组做完实验后,在读书卡上的记录如下所示,则卡片上的描述合理的是( )
如图把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.某实验兴趣小组做完实验后,在读书卡上的记录如下所示,则卡片上的描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲醛 | B. | 维生素E | C. | 小苏打 | D. | 苯甲酸及其钠盐 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 5 s | B. | 大于5 s | C. | 小于5 s | D. | 无法判断 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目: 来源: 题型:解答题
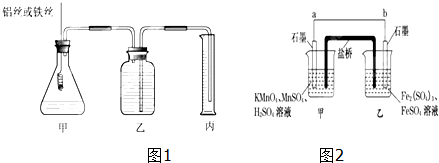
查看答案和解析>>
科目: 来源: 题型:选择题
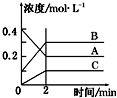
| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
查看答案和解析>>
科目: 来源: 题型:解答题
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图1所示的实验装置.请你根据他们的思路,回答有关的问题.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图1所示的实验装置.请你根据他们的思路,回答有关的问题.查看答案和解析>>
科目: 来源: 题型:选择题
 ,它与过量的酸性高锰酸钾溶液作用得到下列三种化合物:CH3COCH3,CH3COCH2CH2COOH,CH3COOH.若化合物B与A互为同分异构体,且A、B分别与酸性高锰酸钾溶液反应得到的产物相同,则化合物B的结构简式正确的是( )
,它与过量的酸性高锰酸钾溶液作用得到下列三种化合物:CH3COCH3,CH3COCH2CH2COOH,CH3COOH.若化合物B与A互为同分异构体,且A、B分别与酸性高锰酸钾溶液反应得到的产物相同,则化合物B的结构简式正确的是( )| A. | CH3CH=C(CH3)-(CH2)2-C(CH3)=CHCH3 | B. | ( CH3)2C=CH-(CH2)2-C(CH3)=CHCH3 | ||
| C. | ( CH3)2C=C(CH3)-(CH2)2-CH=CHCH3 | D. | ( CH3)2C=CH-(CH2)2-CH=C(CH3)2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com