
科目: 来源: 题型:选择题
| A. | 其他条件不变,向平衡后的体系中加入1mol M,平衡向逆反应方向移动 | |
| B. | 其他条件不变,向平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动 | |
| C. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| D. | 用X表示此反应的反应速率是(0.1-0.2a)mol•L-1min-1 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .写出E→F反应的化学方程式
.写出E→F反应的化学方程式 .
.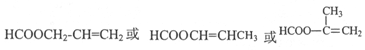 .
.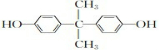 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 (一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”).
(一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”).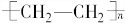 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:3 | B. | 1:3 | C. | 1:1 | D. | 1:2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
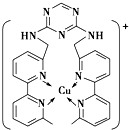 铜、碳、氮、硫、氯等是组成物质的重要元素.
铜、碳、氮、硫、氯等是组成物质的重要元素.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 周期表中同周期元素从左到右,元素的电负性逐渐增大 | |
| B. | 周期表中同主族元素从上到下,元素的电负性逐渐增大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 硝酸钾溶于水 | |
| B. | 氨气和氯化氢反应生成氯化铵晶体 | |
| C. | 水蒸气凝结为液态的水 | |
| D. | (NH4)2CO3分解生成二氧化碳、氨气和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com