
科目: 来源: 题型:填空题
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:查看答案和解析>>
科目: 来源: 题型:解答题
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
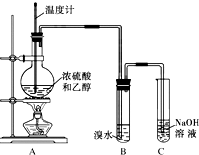 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.查看答案和解析>>
科目: 来源: 题型:填空题
 目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.查看答案和解析>>
科目: 来源: 题型:多选题
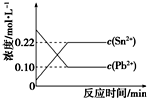 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| C. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 预期现象及实验结论 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com