
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 | |
| B. | 严重影响我国北方的霾尘,其颗粒物是种胶体 | |
| C. | 大力实施矿物燃料“脱硫、脱硝技术”,可减少硫的氧化物和氮的氧化物对环境的污染 | |
| D. | 自来水厂常加入FeSO4和Cl2处理水,达到同时杀菌、消毒和聚沉水体中悬浮物的目的 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气体摩尔体积为22.4L•mol-1 | |
| B. | 1molH2的质量是2g,它所占的体积是22.4L | |
| C. | 1mol水中含有2mol氢和1mol氧 | |
| D. | 在标准状况下,1mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法等 | |
| B. | 第①步中除去粗盐中可溶性杂质,可依次加入Na2CO3、Ba(OH)2、盐酸等试剂 | |
| C. | 在第②③④步中溴元素均被氧化 | |
| D. | 第④步涉及的分离操作有过滤、萃取、蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | Na2SiO3溶液 | C. | NaOH溶液 | D. | NaHSO3溶液、 |
查看答案和解析>>
科目: 来源: 题型:选择题
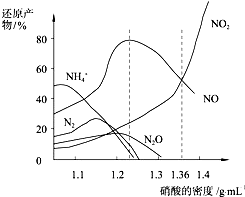
| A. | 密度小于1.1g/mL的硝酸与金属反应,还原产物主要是NH4+ | |
| B. | 当硝酸溶液的密度为1.36g/mL时,Fe与过量硝酸反应的化学方程式为:4Fe+18HNO3=4Fe(NO3)3+3NO+3NO2+9H2O | |
| C. | 稀硝酸与金属反应,一定被还原成NO | |
| D. | 某硝酸试剂瓶的标签注明:密度1.26g/mL,质量分数50.0%;若取该试剂10mL配成1000mL溶液,所得溶液的物质的量浓度为1 mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
 (填“向左”、“向右”或“不”).
(填“向左”、“向右”或“不”).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol | |
| B. | 500℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g)?2NH2(g)△H=-38.6 kJ•mol | |
| C. | 一定条件下,反应 N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol降低温度将向正反应方向移动 | |
| D. | 已知 2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com