
科目: 来源: 题型:选择题
| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | 氯化钠固体不导电,所以氯化钠不是电解质 | |
| C. | 氯化氢溶液能导电,所以氯化氢是电解质 | |
| D. | 氯气溶于水能导电,所以氯气是电解质 |
查看答案和解析>>
科目: 来源: 题型:选择题
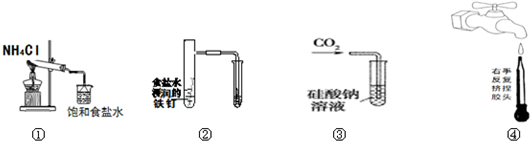
| A. | 实验①制取的氨气溶解在饱和NaCl溶液 | |
| B. | 实验②通过观察右边试管有无倒吸现象说明铁钉是否发生吸氧腐蚀 | |
| C. | 实验③可用于证明碳的非金属性比硅强 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L?1氨水中,c(OH-)=c(NH4+) | |
| B. | 10mL 0.02mol•L?1HCl溶液与10mL 0.02mol•L?1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 | |
| C. | 在0.1mol•L?1 CH3COONa溶液中,c(OH?)=c(CH3COOH)+c(H+) | |
| D. | 0.1mol•L?1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2?)+c(HA?)+c(H2A) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 ,b粒子的电子排布式1s22s22p6.
,b粒子的电子排布式1s22s22p6. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 元素 代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半 径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | G元素的单质不存在同素异形体 | |
| B. | I在DB2中燃烧生成两种化合物 | |
| C. | A的单质能将E单质从HE3的溶液中置换出来 | |
| D. | A、H、J的离子半径由大到小顺序是A>J>H |
查看答案和解析>>
科目: 来源: 题型:解答题
 氨在国民经济中占有很重要的地位.现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料.氨氧化法制硝酸是工业上制硝酸的主要方法.
氨在国民经济中占有很重要的地位.现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料.氨氧化法制硝酸是工业上制硝酸的主要方法.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20(2b-a) mol/L | B. | 20(b-2a) mol/L | C. | 10(2b-a) mol/L | D. | 10(b-2a) mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3COO-、SO42-、K+、Mg2+ | B. | H+、MnO4-、K+、Cl- | ||
| C. | H+、NO3-、Na+、SO42- | D. | OH-、NO3-、Na+、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com