
科目: 来源: 题型:选择题
| A. | 可加入硫酸、氢氧化钾等强电解质以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电过程中,电池正极材料的质量不变 | |
| D. | 放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | X、Y、Z的阴离子电子层结构均与R原子的相同 | |
| B. | 常压下,Y单质的沸点比Z单质的沸点高 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性强 | |
| D. | 最高价氧化物的水化物酸性W比Y强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由氢气燃烧放热可知,2mol氢气的能量高于2mol水的能量 | |
| B. | 燃烧天然气做饭时,其能量转化形式只有化学能转化为热能 | |
| C. | 已知碳酸钙分解为吸热反应,则CaO与CO2反应为放热反应 | |
| D. | 根据能量守恒定律分析钠在氯气中燃烧的反应可知,参与反应的钠与氯气的总能量等于生成的氯化钠的总能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ρ1<ρ2 | B. | ρ1=ρ2 | C. | ρ1>ρ2 | D. | 无法估算 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| B. | 1 mol Zn与足量的该硫酸反应产生2 g H2 | |
| C. | 该硫酸可以用来干燥硫化氢气体 | |
| D. | 若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗 |
查看答案和解析>>
科目: 来源: 题型:解答题
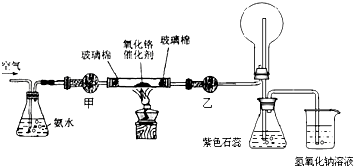
查看答案和解析>>
科目: 来源: 题型:解答题
 | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 升高温度,同时增大压强 | |
| B. | 降低温度.同时减小压强 | |
| C. | 增大反应物的浓度,同时使用适宜的催化剂 | |
| D. | 增大反应物的浓度,同时减小生成物的浓度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(S2-)+c(HS-)+c(H2S)+c(H+)=c(OH-) | B. | c(OH-)=c(HS-)+c(H+)+2 c(H2S) | ||
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S) | D. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com