
科目: 来源: 题型:选择题
| A. | 436kJ | B. | 557kJ | C. | 872kJ | D. | 181kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | (CH3)2C Br CH2 Br | ||
| C. | C2H5CH Br CH2 Br | D. | CH3(CH Br)2CH3 |
查看答案和解析>>
科目: 来源: 题型:解答题

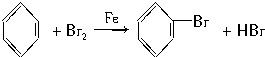 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合气体的体积恒定不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的平均摩尔质量不变 | |
| D. | I2在混合气体中的体积分数与H2在混合气体中的体积分数相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
查看答案和解析>>
科目: 来源: 题型:解答题
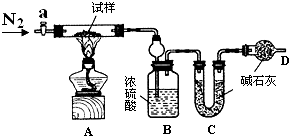 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m2、m5 |
查看答案和解析>>
科目: 来源: 题型:解答题
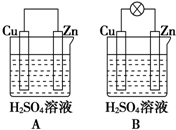 观察图A、B,回答下列问题:
观察图A、B,回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
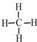 .乙烯的电子式是
.乙烯的电子式是 .将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5
.将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5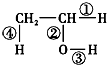 在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.
在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.查看答案和解析>>
科目: 来源: 题型:填空题
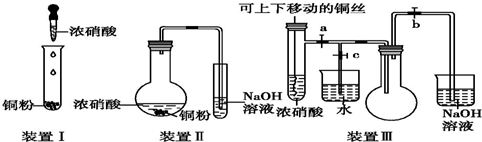
查看答案和解析>>
科目: 来源: 题型:解答题
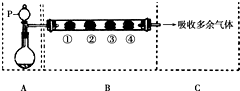 用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:
用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘 水混合液 | 氢硫酸 |
| 现象 | a | b | 褪色 | 浅黄色 |
| 体现SO2的性质 | c | d | e | f |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com