
科目: 来源: 题型:选择题
| A. | 该溶液中一定不含Ba2+ | |
| B. | 该溶液中一定含Na+ | |
| C. | 无色气体在标准状况下的体积约为2.24L | |
| D. | 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 |
查看答案和解析>>
科目: 来源: 题型:解答题
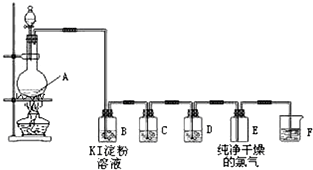
查看答案和解析>>
科目: 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:
.H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
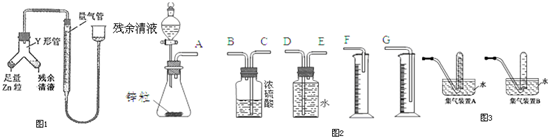
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
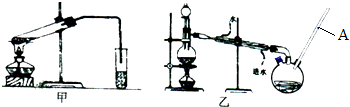
查看答案和解析>>
科目: 来源: 题型:选择题
 将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示).据此判断下列说法正确的是( )
将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示).据此判断下列说法正确的是( )| A. | 外电路中电流方向为X→Y | |
| B. | 若电极材料分别为锌片和铜片,则Y为锌片 | |
| C. | X极上发生还原反应 | |
| D. | 若电极材料都是金属,则金属活动性:X>Y |
查看答案和解析>>
科目: 来源: 题型:选择题
 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构简式如图.有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构简式如图.有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生加聚反应 | |
| C. | 1 mol该化合物完全燃烧消耗18molO2 | |
| D. | 该物质能使溴水和酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com