
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
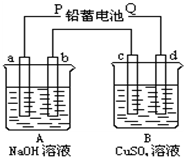 用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).查看答案和解析>>
科目: 来源: 题型:解答题
 实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | H-H | H-F | H-Br | H-I |
| 键能(kJ/mol) | 436 | 565 | 368 | 297 |
| A. | 氢气 | B. | 氟化氢 | C. | 溴化氢 | D. | 碘化氢 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能∕(kJ•mol-1) | 436 | 243 | 431 |
| A. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=+91.5 kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
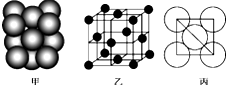 铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.
铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.查看答案和解析>>
科目: 来源: 题型:解答题
 .A经①②两步反应得到C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如图所示.
.A经①②两步反应得到C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如图所示.
 .
. 和
和 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液500mL,根据这种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液500mL,根据这种溶液的配制情况回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com