
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO3-、Cl-、Fe3+、K+ | B. | Cl-、Ag+、NO3-、Na+ | ||
| C. | SO42-、Al3+、Na+、Cl- | D. | NO3-、HCO3-、Na+、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
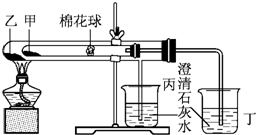 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| B. | Ⅱ中的澄清石灰水变浑浊 | |
| C. | Ⅲ中紫色石蕊试液变红 | |
| D. | 鸡蛋壳发生了分解反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
 在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.
在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.| 实验现象 | 原因 |
| 溶液最初从紫色变为红色 | 氯气与水反应生成的HCl使石蕊试液变红 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 最后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应的速率越大,化学反应的限度越大 | |
| B. | 质量数不同的原子互称同位素 | |
| C. | 糖类、油脂、蛋白质都能发生水解 | |
| D. | 油脂有油和脂肪之分,但都属于酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com