
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无法确定 | B. | 0.2mol | C. | 0.4mol | D. | 0.5mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (b-2a) mol | B. | $\frac{b}{2}$mol | C. | $\frac{2a}{3}$ mol | D. | 2a mol |
查看答案和解析>>
科目: 来源: 题型:解答题
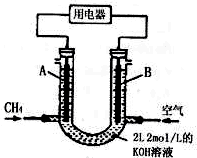 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
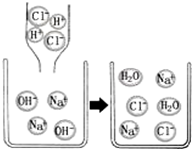
| A. | 反应前后所有元素种类不变 | |
| B. | 恰好反应后溶液的pH大于7 | |
| C. | 反应前的溶液可导电,反应后的溶液不导电 | |
| D. | 中和反应的实质是Na+和Cl-反应生成NaCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | O2完全转化为SO3 | |
| B. | SO2、O2、SO3同时存在 | |
| C. | SO2、O2与SO3的浓度不再随时间变化 | |
| D. | SO2、O2与SO3的物质的量之比为2:1:2 |
查看答案和解析>>
科目: 来源: 题型:解答题

 ;②中离子方程式为Br-+Ag+═AgBr↓;
;②中离子方程式为Br-+Ag+═AgBr↓;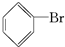 、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗;
、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗; ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 49 | B. | 50 | C. | 51 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com