
科目: 来源: 题型:解答题
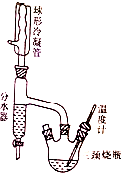 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 4.7 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
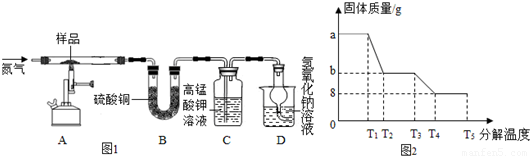
查看答案和解析>>
科目: 来源: 题型:解答题
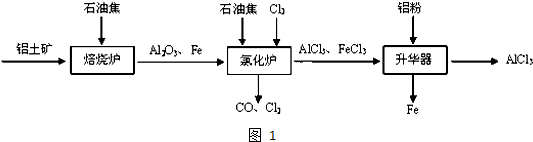
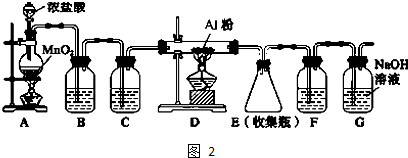
查看答案和解析>>
科目: 来源: 题型:解答题
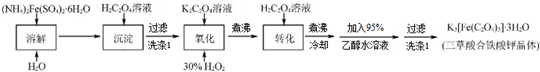
查看答案和解析>>
科目: 来源: 题型:解答题
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23-26 |
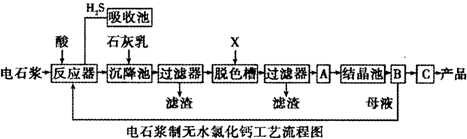
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
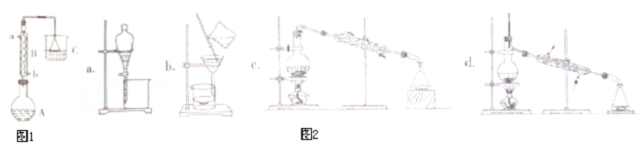
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com