
科目: 来源: 题型:选择题
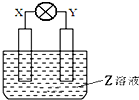 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )| X | Y | Z | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 锌 | 铜 | 硝酸银溶液 |
| D | 碳 | 锌 | 硝酸铜溶液 |
| A. | 锌做负极溶解X电极变轻,错误 | |
| B. | 铁做负极失电子溶解变轻,X电极生成氢气不会变重,错误 | |
| C. | 锌做负极溶解X电极变轻,错误 | |
| D. | 锌做负极失电子发生氧化反应Y棒变轻,碳做正极溶液中铜离子析出使X极变重,正确 |
查看答案和解析>>
科目: 来源: 题型:解答题
 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期元素形成的单质中是最高的;F2+核外各亚层电子均已充满.
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期元素形成的单质中是最高的;F2+核外各亚层电子均已充满.查看答案和解析>>
科目: 来源: 题型:解答题
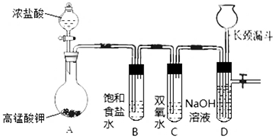 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题:
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题: HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.
HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).查看答案和解析>>
科目: 来源: 题型:解答题
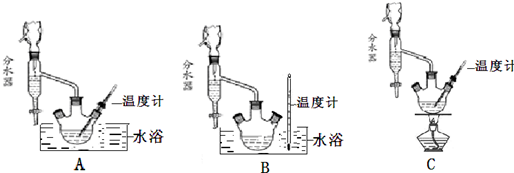
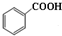 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 达到平衡所需要时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化剂 | |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 冶炼过程中的尾气可用来制硫酸 | |
| B. | 上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| D. | 通过分析可知常温下Kb(NH3•H2O)>Ka1(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com