
科目: 来源: 题型:多选题
| A. | Ba(OH)2溶液与稀H2SO4反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | Al(OH)3沉淀中滴加盐酸 Al(OH)3+3H+═Al3++3H2O | |
| D. | FeCl2溶液中通入Cl2:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{28m}{n}$ | B. | $\frac{14m}{n}$ | C. | $\frac{n}{28m}$ | D. | $\frac{n}{14m}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
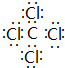 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.查看答案和解析>>
科目: 来源: 题型:解答题
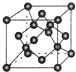 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 含氢原子的物质之间均可形成氢键 | |
| D. | 分子间形成的氢键使物质的熔点和沸点升高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. | 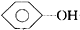 +NaHCO3→ +NaHCO3→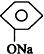 +H2CO3 +H2CO3 | |
| C. | 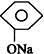 +CO2+H2O→ +CO2+H2O→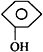 +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→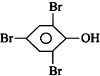 ↓+3HBr ↓+3HBr |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ca(HCO3)2溶液与少量的NaOH溶液混合2HCO3-+Ca2++2OH-═2 H2O+CaCO3↓+CO32- | |
| C. | 磁性氧化铁溶液与稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | NH4HCO3溶液与过量的NaOH溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
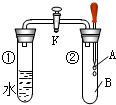 如图所示,试管①中盛有98℃的水,试管②中充满气体B,将液体A滴入试管②中,充分反应后打开活塞K,发现试管①中的水立刻沸腾.则A与B可能是( )
如图所示,试管①中盛有98℃的水,试管②中充满气体B,将液体A滴入试管②中,充分反应后打开活塞K,发现试管①中的水立刻沸腾.则A与B可能是( )| A. | 苯和氢气 | B. | 稀硫酸与一氧化碳 | ||
| C. | 饱和食盐水与氯气 | D. | 浓溴水和乙烯 |
查看答案和解析>>
科目: 来源: 题型:解答题
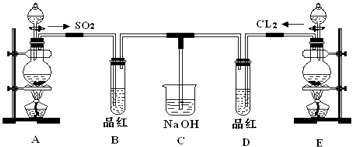
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com