
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
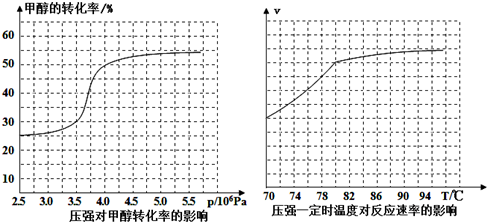
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
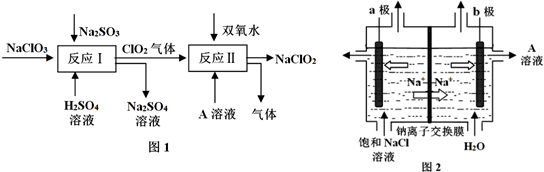
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 物质编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | 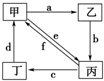 | Cu | CuO | CuCl2 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Al(OH)3 | Al2O3 | Na[Al(OH)4] | AlCl3 |
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
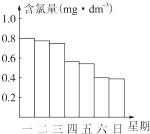
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 这种饮料不含任何化学物质 | |
| B. | 长期饮用纯水,对身体有益 | |
| C. | 这种“神奇液体”加入水中,可以“以水代油”作为发动机的燃料 | |
| D. | 没有水就没有生命 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com