
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题

 )结构
)结构 

 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 化合物 | 甲烷 | 乙烷 | 丙烷 | 正丁烷 | 异丁烷 | 异戊烷 |
| 燃烧热 (kJ•mol-1) | 891.0 | 1560.8 | 2221.5 | 2878.0 | 2869.6 | 3531.3 |
| A. | 正丁烷?异丁烷△H<0 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═CO2(g)+6H2O(g)△H=-1560.8 kJ•mol-1 | |
| C. | 正戊烷的燃烧热数值小于3531.3 kJ•mol-1 | |
| D. | 相同质量的烷烃,随碳原子数增加,燃烧放出的热量增多 |
查看答案和解析>>
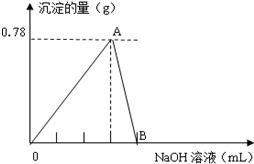
科目: 来源: 题型:解答题
查看答案和解析>>
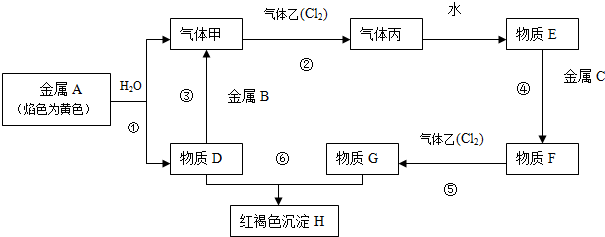
科目: 来源: 题型:解答题
 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.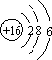 ;羰基硫分子的电子式为
;羰基硫分子的电子式为 .
.查看答案和解析>>
科目: 来源: 题型:多选题
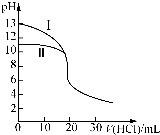 室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
查看答案和解析>>
科目: 来源: 题型:解答题

 或
或 (写结构简式).
(写结构简式). ;D→E
;D→E .
. 和
和 ,则鉴别G和H的试剂为溴水或溴的四氯化碳溶液.
,则鉴别G和H的试剂为溴水或溴的四氯化碳溶液. )的A的同分异构体中,其中能与NaOH溶液反应的有11种;能发生酯化反应的有
)的A的同分异构体中,其中能与NaOH溶液反应的有11种;能发生酯化反应的有 (写结构简式).
(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com