
科目: 来源: 题型:选择题
| A. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L | |
| B. | 2.3 g Na被O2完全氧化时,失去电子数为0.1NA | |
| C. | 2 L 1 mol•L-1的盐酸中所含氯化氢分子数约为2NA | |
| D. | 标准标况下,5.6 L CCl4含有的分子数为0.25NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| C. | 同素异形体:活性炭,C60,C80,金刚石 | |
| D. | 混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石 |
查看答案和解析>>
科目: 来源: 题型:解答题
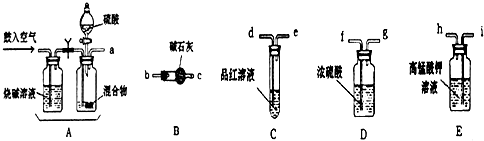
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4.8g石墨中的共价键数目 | |
| B. | 250mL1mol•L-1FeCl3溶液中,阴、阳离子总数 | |
| C. | 一定条件下,将1mol SO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数 | |
| D. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,生成0.5 molCl2转移的电子数 |
查看答案和解析>>
科目: 来源: 题型:解答题
 为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).
为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
常温下,有些盐如CaCl2、NaCl等物质的水溶液呈中性;有些盐如Na2CO3等物质的水溶液呈碱性;有些盐如NH4Cl等物质的水溶液呈酸性.现有HCl与CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com