
科目: 来源: 题型:选择题
| A. | 16:9 | B. | 23:9 | C. | 32:9 | D. | 46:9 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,1mol任何物质的体积都约为22.4 L | |
| B. | 1mol任何气体所含分子数都相等,体积也都约为22.4L | |
| C. | 相同状况下,1L CO一定比1L O2的质量小 | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| B. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 | |
| C. | 称量时托盘上要垫上干净的称量纸 | |
| D. | 定容摇匀后发现液面下降,不应再加蒸馏水 |
查看答案和解析>>
科目: 来源: 题型:解答题
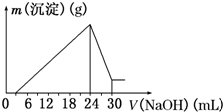 铝是现今人类生产生活中使用广泛性仅次于铁的重要金属.工业上常以“钒土矿”为原料来冶炼金属铝.已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质).为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
铝是现今人类生产生活中使用广泛性仅次于铁的重要金属.工业上常以“钒土矿”为原料来冶炼金属铝.已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质).为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:查看答案和解析>>
科目: 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液. ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀. ②无明显现象 | 白色物质为Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
 小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A | B | C | D | |
| X | FeCl2溶液 | FeCl2溶液 | Fe | FeSO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Fe2(SO4)3 |
| Z | Cl2 | Fe | NaOH溶液 | Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. .
. .
. 合成D 的路线流程图(其他原料任选)合成
合成D 的路线流程图(其他原料任选)合成查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com