
科目: 来源: 题型:选择题
| A. | Fe2O3是一种酸性氧化物 | |
| B. | 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 | |
| C. | 分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为 3:2:3 | |
| D. | 明矾属硫酸盐,含结晶水,是混合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| C. | 氢氧化铁胶体的电泳实验能证明氢氧化铁胶体带正电 | |
| D. | 在体积相同的两个密闭容器中分别充满O2和O3气体,当这两个容器内温度和气体密度相等时,两种气体的氧原子数目相等 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
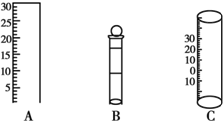 如图所示为中学化学实验中几种常见仪器的部分结构:
如图所示为中学化学实验中几种常见仪器的部分结构:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com