
科目: 来源: 题型:选择题
| A. | HCI和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ?mol-1 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用含0.lmolFeCl3的溶液与足量沸水反应制得的Fe(0H)3胶体中胶粒数为0.1NA | |
| B. | 46g N02和N204的混合气体中含原子总数为NA | |
| C. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| D. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C02的电子式::$\underset{\stackrel{…}{O}}{…}$:$\underset{\stackrel{…}{C}}{…}$:$\underset{\stackrel{…}{O}}{…}$ | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 乙烯的比例模型 | D. | 铝离子结构示意图: |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | c | D | |
| 用 品 |  |  |  |  |
| 主要成分 | CO2 | Fe2O3 | NaHCO3 | C12H22011 |
| 用途 | 做制冷剂 | 做红色涂料 | 除油污 | 做调味剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.2NA | |
| C. | 0.1mol N2与足量的H2反应,转移的电子数为0.6NA | |
| D. | 用惰性电极电解1L0.1mol•L-1 CuCl2溶液,当有0.2NA个电子通过时,可生成6.4g铜 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.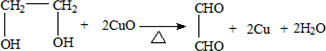 .
. .
.
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 |

查看答案和解析>>
科目: 来源: 题型:解答题
 过氧乙酸常用作氧化剂和灭菌剂.实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂.实验室合成过氧乙酸并测定其含量的相关步骤如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com