
科目: 来源: 题型:解答题
 将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:
将锌片和铜片插入稀硫酸中构成如图1所示的装置,请回答下列问题:| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
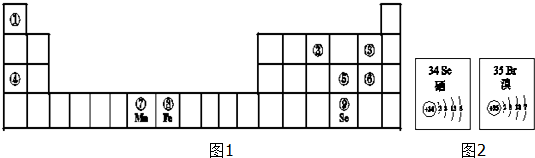
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

 .D物质的名称是乙醛.
.D物质的名称是乙醛.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 给定条件下SO2的转化率达到最大值 | |
| B. | SO2的消耗速率与生成速率相等 | |
| C. | 密闭容器中同时存在SO2、O2、SO3 | |
| D. | 各组分浓度不再随时间改变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 操作 | 实验现象 | 结论 | |
| A | 将铝片放入盐酸中 | 产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| B | 将形状大小相近的Mg和Al片分别放入相同浓度的盐酸中 | Mg与盐酸反应比Al剧烈 | Mg比Al的金属性强 |
| C | 氢气在氯气中点燃 | 有苍白色火焰,瓶口有白雾 | 其中 过程 过程吸收能量 |
| D | 将一小块钠投入冷水中 | 钠熔化成小球 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性:H2SO4>H3PO4 | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 热稳定性:Na2CO3>NaHCO3 | D. | 非金属性:Cl>Br |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2CH3与 互为同分异构体 互为同分异构体 | |
| B. | 乙烷和异丁烷互为同系物 | |
| C. | 有机物分子中碳原子通过四对共用电子对与其它原子相结合 | |
| D. | C5H12存在三种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com