
科目: 来源: 题型:解答题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |

查看答案和解析>>
科目: 来源: 题型:解答题

 ,无水HF的作用是反应物和溶剂
,无水HF的作用是反应物和溶剂查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
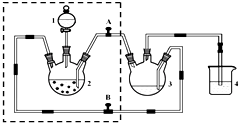 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
 为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目: 来源: 题型:解答题
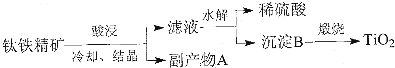
查看答案和解析>>
科目: 来源: 题型:解答题
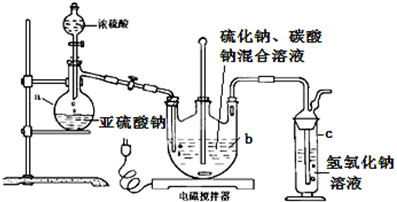
 K3[Fe(C2O4)3]•3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂.实验室可用废铁屑等物质为原料制备,并测定产品的纯度.相关反应的化学方程式为:
K3[Fe(C2O4)3]•3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂.实验室可用废铁屑等物质为原料制备,并测定产品的纯度.相关反应的化学方程式为:查看答案和解析>>
科目: 来源: 题型:解答题
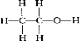 .
.| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com