
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 氯化亚锡有广泛的用途,工业可用作催化剂、脱氧剂等.如下是某实验室常用的一种制取无水氯化亚锡的步骤:
氯化亚锡有广泛的用途,工业可用作催化剂、脱氧剂等.如下是某实验室常用的一种制取无水氯化亚锡的步骤:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
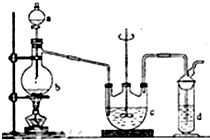 硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.
某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.查看答案和解析>>
科目: 来源: 题型:解答题
 Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O| 实验步骤 | 现象及结论 |
| 步骤Ⅰ:对三颈烧瓶分离出的产品进行重结晶得到纯净的Na2S2O4(仅需说明方法) | |
| 步骤Ⅱ:取0.1g步骤Ⅰ的产品溶于5mL银氨溶液,振荡,水浴加热10s,观察现象 | 若10S出现银镜,则甲的结论正确(或Na2S2O4具有还原性),反之则乙正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com