
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
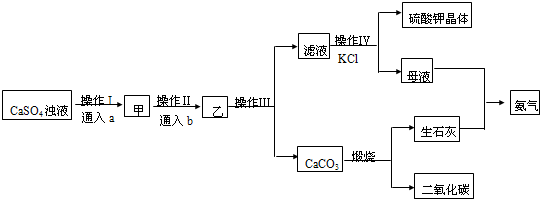
查看答案和解析>>
科目: 来源: 题型:解答题

| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g•cm-3 | 难溶于水,易溶于醇,醚生等有机溶剂 |
查看答案和解析>>
科目: 来源: 题型:解答题

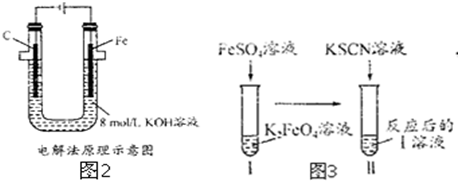
查看答案和解析>>
科目: 来源: 题型:解答题
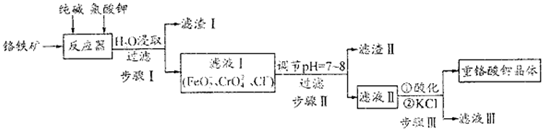
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
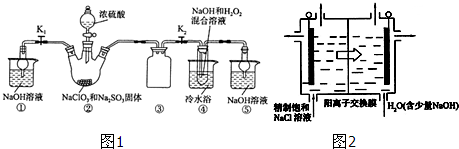
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com