
科目: 来源: 题型:解答题
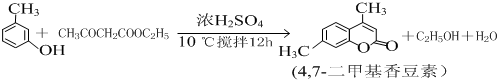
查看答案和解析>>
科目: 来源: 题型:解答题
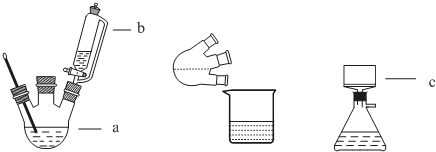
查看答案和解析>>
科目: 来源: 题型:解答题
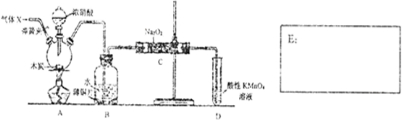
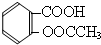 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2: .
. +3NaOH
+3NaOH CH3COONa+2H2O+
CH3COONa+2H2O+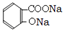 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
| 药品名称 | 熔点/℃ | 沸点/℃ | 密度g/cm3 | 溶解性 |
| 正丁醇 (CH3CH2CH2OH) | -89.5 | 117.7 | 0.8098 | 微溶于水,溶于浓硫酸 |
| l-溴丁烷 (CH3CH2CH2CH2Br) | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |

查看答案和解析>>
科目: 来源: 题型:解答题
 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:查看答案和解析>>
科目: 来源: 题型:解答题
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 23.3g | 19.7g |

查看答案和解析>>
科目: 来源: 题型:解答题
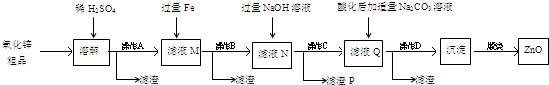
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com