
科目: 来源: 题型:选择题
| A. | 甲烷分子中的C-H键完全相同 | |
| B. | 甲烷分子的结构具有对称性 | |
| C. | 甲烷分子的二氯代物只有一种结构 | |
| D. | 分子组成为CHCl3的物质具有固定的熔、沸点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=7的溶液 | |
| B. | c(OH-)=$\sqrt{{K}_{W}}$ | |
| C. | 由强酸与强碱等物质的量反应得到的溶液 | |
| D. | 强电解质溶于水得到的溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2 | B. | SO2 | C. | H2O2 | D. | NaClO |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解精炼铜时,粗铜与电源正极相连 | |
| B. | 在海轮外壳上镶入锌块,是牺牲阳极的阴极保护法 | |
| C. | 用Na2S作沉淀剂,除去废水中Cu2+和Hg2+ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
查看答案和解析>>
科目: 来源: 题型:填空题
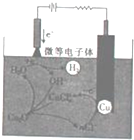 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂灯领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂灯领域有着广泛的用途.回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
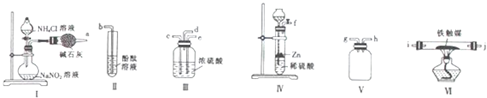
 f,e;d,i,j,g,h,b(填玻璃接口字母)
f,e;d,i,j,g,h,b(填玻璃接口字母)查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测液中SO42-时,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO32-、SO32-等离子干扰 |
| B | 制备乙酸乙酯时,导管应伸入试管至饱和Na2CO3溶液液面上方 | 乙酸乙酯易溶于碳酸钠溶液,防止发生倒吸 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 电池放电时Li+向负极移动 | |
| B. | 电池放电时,正极的电极反应式为:2Li++Li2O2+2e-═2Li2O | |
| C. | 电池充电时,Li极应与外电源的正极相连 | |
| D. | 电池系统内进入二氧化碳及水对电池性能不会产生影响 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 50mL18.4mol.L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| B. | 某密闭容器盛有0.1molNA和0.3molH2,充分反应后转移电子的数目为0.6NA | |
| C. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA | |
| D. | 常温下1L0.1mol.L-1NH4NO3溶液中的氢原子数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com