
科目: 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2,②NH4Cl,③NH3•H2O,④CH3COONH4中,c(NH4+)由大到小的顺序是:①>②>④>③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④⑥ | B. | ②⑤ | C. | ③⑤⑥⑧ | D. | ②③④⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al2O3 | B. | N2 | C. | C | D. | Al2O3 和C |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
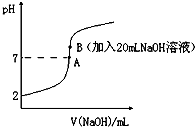 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 正极反应为Ag-e-=Ag+ | |
| D. | 用KCl溶液代替盐酸,则电池总反应随之改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com