
科目: 来源: 题型:填空题
| 选用试剂 | 实验现象 | |
| 方案1 | b | 下层(CCl4层)无色 |
| 方案2 | d | 溶液变为血红色 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为:
硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为: .
.查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
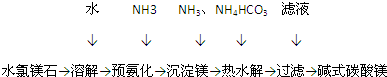
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com