
科目: 来源: 题型:选择题
| A. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的核外电子数相同,是同一种核素 | |
| B. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的中子数相同,互称为同位素 | |
| C. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质子数相同,互称为同位素 | |
| D. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质量数相同,不能互称为同位素 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示,钠、镁、铝、铁分别跟足量的氯气反应时,消耗金属的质量与反应的氯气的质量之间的关系,其中表示铝与氯气反应的是( )
如图所示,钠、镁、铝、铁分别跟足量的氯气反应时,消耗金属的质量与反应的氯气的质量之间的关系,其中表示铝与氯气反应的是( )| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目: 来源: 题型:解答题
 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
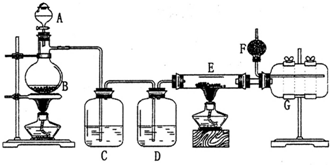
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4 固体于试管中,加入一定量水溶解 | |
| 步骤二: |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a的值为3 | B. | 平衡时X的浓度为0.8mol/L | ||
| C. | Y的转化率为60% | D. | 反应速率v(Y)=0.2mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
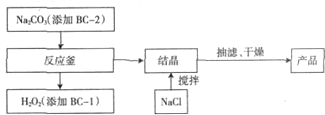
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com