
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 温度 | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 有A、B、C、D、E、F六种物质,它们的相互转化关系如图(反应条件及部分产物乙略).已知A、B、E均为单质,B、E在常温下为气体,C为淡黄色固体.回答下列问题:
有A、B、C、D、E、F六种物质,它们的相互转化关系如图(反应条件及部分产物乙略).已知A、B、E均为单质,B、E在常温下为气体,C为淡黄色固体.回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
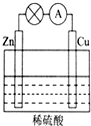 (1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
(1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.查看答案和解析>>
科目: 来源: 题型:填空题
 ,C元素最高价氧化物对应的水化物的电子式
,C元素最高价氧化物对应的水化物的电子式 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H4、C2H2 | B. | CH4、C2H6 | C. | CH4、C2H4 | D. | C2H2、C3H6 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 A(g)+3B(g)?2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示,现象一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应发到平衡状态Ⅰ后,再升高温度,继续反应一段时间后达到平衡状态Ⅱ.下列叙述中正确的是( )
A(g)+3B(g)?2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示,现象一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应发到平衡状态Ⅰ后,再升高温度,继续反应一段时间后达到平衡状态Ⅱ.下列叙述中正确的是( )| A. | T1>T2,该反应生成物的总能量高于反应物的总能量 | |
| B. | 该反应在高温时才能自发进行 | |
| C. | 由平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化 | |
| D. | 反映从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,则1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com