
科目: 来源: 题型:选择题
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C | 溶液褪色为浅绿色 |
| 饱和FeCl3溶液滴入沸水中 | 得到红褐色液体 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
| A. | 维生素C具有还原性 | B. | FeCl3水解生成Fe(OH)3胶体 | ||
| C. | 铜锈与盐酸反应有H2生成 | D. | 铜锈中含有碳酸根 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室常用铝盐溶液与氢氧化钠溶液制备Al(OH)3沉淀 | |
| B. | 浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 | |
| C. | SO2 具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | |
| D. | 30%的H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
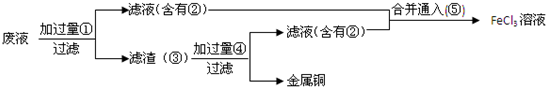
查看答案和解析>>
科目: 来源: 题型:解答题
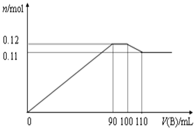 向100mLBaCl2、AlCl3、FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如图所示:
向100mLBaCl2、AlCl3、FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如图所示:| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| c/mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 | |
| ① | Cl2 | FeBr3 | Cl- | ||
| ② | KMnO4 | H2O2 | H2SO4 | Cl2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | O2 |
| A. | 表中①组反应可能有一种或两种元素被氧化 | |
| B. | 表中②组反应的离子方程式是2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| C. | 表中③组反应的还原产物是KC1,电子转移数目是6e- | |
| D. | 氧化性强弱比较:KClO3>Fe3+>Cl2>Br2 |
查看答案和解析>>
科目: 来源: 题型:填空题
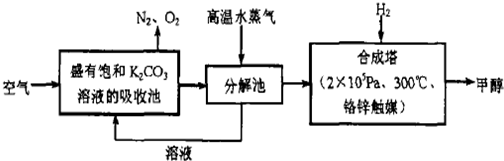
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气通入氯化亚铁溶液中:Cl2+Fe2+=2Cl-+Fe3+ | |
| B. | 碳酸钠溶于醋酸溶液中:CO32-+2 H+=H2O+CO2↑ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| D. | 硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com