
科目: 来源: 题型:选择题
| A. | NaHCO3的热稳定性大于Na2CO3 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,体现了二氧化硫的漂白性 | |
| D. | 浓H2SO4在加热条件下可与铜反应,浓硫酸表现了酸性和强氧化性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下32g O2和O3所含的原子数为2NA | |
| B. | 标准状况下22.4L CCl4所含的分子数为NA | |
| C. | 1mol/L CaCl2溶液中所含的Cl-离子数为2NA | |
| D. | 56 g Fe与任何物质完全反应时转移的电子数一定为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀盐酸,Na2CO3溶液 | B. | 稀H2SO4溶液,NaAlO2溶液 | ||
| C. | Cl2,NaBr溶液 | D. | CO2,澄清石灰水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质硅可用于制造光纤和太阳能电池 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | 食盐是氯碱工业的基础原料 | |
| D. | Na2O2用作呼吸面具的供氧剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2gO3和2 gO2 | B. | 9克H2O和0.5NA个CO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和4.48LHCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽车尾气的大量排放--光化学污染--咳嗽和气喘者增多 | |
| B. | 生活污水任意排放--空气中CO2浓度增大--温室效应 | |
| C. | 含磷洗衣粉的大量使用--水体富营养化--水栖生物大量死亡 | |
| D. | 劣质装饰材料的大量使用--甲醛、苯等释放--致癌 |
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正价依次增大 | |
| C. | Na、K、Rb电负性逐渐减小 | |
| D. | P、S、Cl元素最高价含氧酸酸性依次增强 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.
 +CaCl2+H2O
+CaCl2+H2O
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
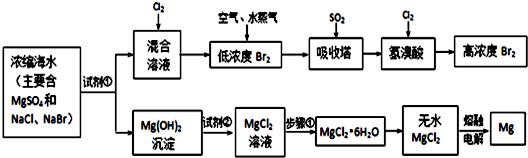
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com