
科目: 来源: 题型:解答题
| X | ||
| Y | ||
| Z |
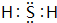 ,该分子中含2个σ键,0个π键(若不含填0).
,该分子中含2个σ键,0个π键(若不含填0).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质子数c>b | B. | 离子的还原性Z->Y2- | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目: 来源: 题型:解答题
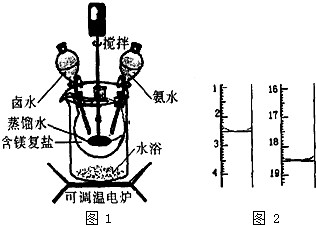 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
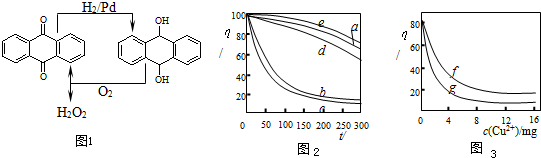
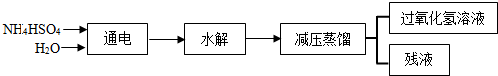
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
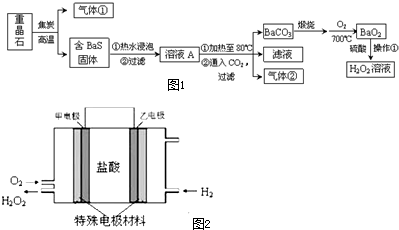
查看答案和解析>>
科目: 来源: 题型:选择题
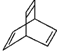 表示.下列说法不正确的是( )
表示.下列说法不正确的是( )| A. | X属于烃 | |
| B. | X能使酸性高锰酸钾溶液褪色 | |
| C. | X与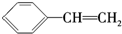 互为同分异构体 互为同分异构体 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com