
科目: 来源: 题型:选择题
| A. | 100 g 98%的浓硫酸中含氧原予总数为4NA | |
| B. | 常温常压下,18g重水(D2O)中所含的电子数为10 NA | |
| C. | 常温常压下,4.6 g NO2气体含有0.3 NA个原子 | |
| D. | 常温下,2.7g、铝片投入足量的浓硫酸中,产生的SO2,分子数为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 容器中混合气体的平均相对分子质量增大 | |
| B. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 正反应速率和逆反应速率都变小,C的百分含量增加 | |
| D. | 混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 如图所示正反应的活化能为E-E 1 | |
| B. | 活化分子具有比普通分子更高的能量 | |
| C. | 反应物的分子的每次碰撞都能发生化学反应 | |
| D. | 反应物分子间的有效碰撞是发生化学反应的充要条件 |
查看答案和解析>>
科目: 来源: 题型:解答题
 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成:
 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
 已知氮化铝的晶胞结构如图所示.请回答下列问题:
已知氮化铝的晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目: 来源:2017届广东省高三月考二化学试卷(解析版) 题型:简答题
2011年12月30日中国环境保护部通过了新修订的《环境空气质量标准》,调整了污染物项目及限值,增设了PM2.5平均浓度限值,收紧了NO2等污染物的浓度限值。
(1)①甲烷是一种清洁燃料,在一定条件下,发生反应:CH4(g)+H2O(g)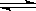 CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。

(2)某工厂利用尾气CO制甲醇,在一定压强和固定容积的容器中,通入a molCO与2a mol H2,在催化剂作用下反应:CO(g)+2H2(g) 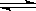 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:

①P1 P2(填“<”、“>”或“=”)。
②下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
③如下图是该反应在不同温度下CO的转化率随时间变化的曲线。请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线

(3)某硝酸处理NO2方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) =-483.6kJ/mol
=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) =+67.7kJ/mol
=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
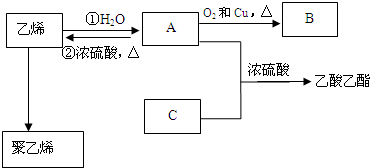
 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基. $→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com