
科目: 来源: 题型:解答题
 (1)电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:
(1)电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 加入更多锌片 | ||
| C. | 加入适量的氯化钠溶液 | D. | 加入数滴氯化铜溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 工业上利用电解YCl3来获得金属单质Y | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 可以利用电解法获得金属单质X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 燃料的燃烧反应都是放热反应 | |
| B. | 一定量的燃料完全燃烧放出的热量比不完全燃烧放出的热量大 | |
| C. | 放热反应的逆反应一定是吸热反应 | |
| D. | 选择燃料只要考虑燃料热值的大小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl-,AlO2-,SO32-,Na+ | B. | NO3-,CH3COO-,Na+,NH4+ | ||
| C. | Cl-,NO3-,Mg2+,K+ | D. | SO42-,HCO3-,Cl-,K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性强弱:HIO4>HBrO4 | B. | 原子半径大小 Na>S>O | ||
| C. | 碱性强弱KOH>NaOH | D. | 金属性强弱Na>Mg>Al |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯水中有平衡Cl2+H2O?HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,体积缩小,压强增大可使颜色变深 | |
| C. | 合成氨反应中用过量氮气与氢气反应可以提高氢气的转化率 | |
| D. | 将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{4}{5}$v(NH3)=v(O2) | B. | $\frac{5}{6}$v(O2)=v(H2O) | C. | $\frac{3}{2}$v(NH3)=v(H2O) | D. | $\frac{5}{4}$v(O2)=v(NO) |
查看答案和解析>>
科目: 来源: 题型:解答题
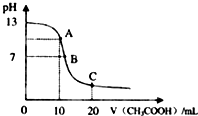 某学生在实验室测定一未知浓度的稀盐酸,已知25℃时,在20ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知25℃时,在20ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积 | 19.00 | 21.81 | 21.79 |
查看答案和解析>>
科目: 来源: 题型:解答题
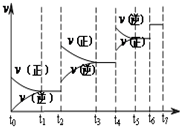 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com