
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
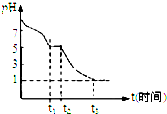
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
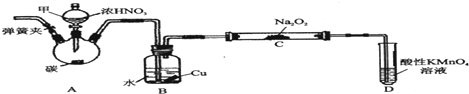

查看答案和解析>>
科目: 来源: 题型:解答题
 某研究性小组探究乙酸乙酯的反应机理,实验如下:
某研究性小组探究乙酸乙酯的反应机理,实验如下:| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |


 后脱水,失水有两种可能分别生成
后脱水,失水有两种可能分别生成 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 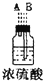 | 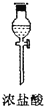 |  | 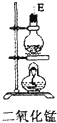 | 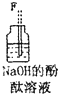 |
查看答案和解析>>
科目: 来源: 题型:解答题
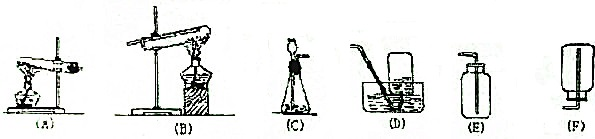
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com