
科目: 来源: 题型:解答题
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 阳极:Cu-2e-═Cu2+ 阴极:Cu2++2e-═Cu | |
| B. | 阳极:2Cu+2I--2e-═2CuI 阴极:2H++2e-═H2↑ | |
| C. | 阳极:2I--2e-═I2 阴极:2H++2e-═H2↑ | |
| D. | 阳极:4OH--4e-═2H2O+O2↑ 阴极:4H++4e-═2H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
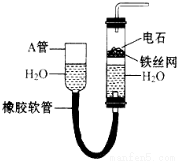 如图装置可以制取乙炔,请填空:
如图装置可以制取乙炔,请填空:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO${\;}_{3}^{2-}$、OH-、Na+、H+ | B. | Al3+、Na${\;}_{\;}^{+}$、HCO${\;}_{3}^{-}$、Cl- | ||
| C. | Ca2+、HCO${\;}_{3}^{-}$、OH-、SO${\;}_{4}^{2-}$ | D. | S2-、H+、SO${\;}_{4}^{2-}$、Cu2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入适量的HNO3,抑制NH${\;}_{4}^{+}$水解 | B. | 加入适量的氨水,使溶液的pH等于7 | ||
| C. | 再加入适量的NH4NO3(s) | D. | 加入适量的NaOH,使溶液的pH等于7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,降低压强,增加氮气 | B. | 降低温度,增大压强,加入催化剂 | ||
| C. | 升高温度,增大压强,增加氮气 | D. | 降低温度,增大压强,分离出部分氨 |
查看答案和解析>>
科目: 来源: 题型:填空题
 已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | b一定显中性 | B. | a可能显酸性或碱性 | ||
| C. | a不可能显酸性 | D. | b可能显碱性或酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com