
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 | |
| B. | 发生氧化还原反应时,A原子失去的电子比B原子多,证明A的金属性一定比B强 | |
| C. | 适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI3 | |
| D. | 一定量氯气通入30 mL 10.00 mol•L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25 |
查看答案和解析>>
科目: 来源: 题型:选择题
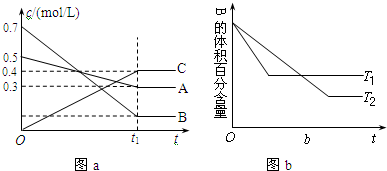
| A. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| B. | T℃时,若在该容器中由0.4mol/LA、0.4mol/LB和0.2mol/LC反应,达到平衡后,C的浓度仍为0.4mol/L | |
| C. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| D. | (t1+10)min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电池工作时,储氢合金作负极 | |
| B. | 电池充电时,阳极发生氧化反应 | |
| C. | 电池工作时,负极反应式:LaNi5H6+6OH--6e-═LaNi5+6H2O | |
| D. | 电池放电时,电子由正极通过外电路流向负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q 1>Q 2 | B. | Q 1=Q 2 | C. | Q 1<Q 2 | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | 从海水提取物质都必须通过化学反应才能实现 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | 葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com