
科目: 来源: 题型:选择题
| A. | 稀氨水 | B. | 硝酸 | C. | 矿物质水 | D. | 氢氟酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅胶不可以用作食品干燥剂 | |
| B. | 五氧化二磷可以用作食品干燥剂 | |
| C. | 六水合氯化钙可以用作食品干燥剂 | |
| D. | 加工后具有吸水性的植物纤维可以用作食品干燥剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
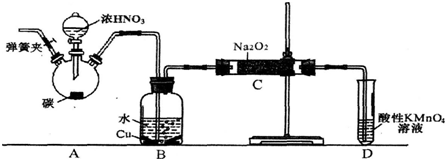
查看答案和解析>>
科目: 来源: 题型:解答题
 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度 | 20℃ | 40℃ | 60℃ | 100℃ |
| 溶解度(s) | 5.0g | 8.7g | 14.8g | 40.2g |
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| pH | 3.0 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si+2CO↑ |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2,乙烷的结构简式为CH3CH3 | |
| B. | 乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不都在同一平面上 | |
| C. | 乙烯分子中含有碳碳双键,乙烷分子中含有碳碳单键,双键不如单键稳定,导致乙烯的性质比乙烷活泼 | |
| D. | 乙烯分子中因含有不饱和键,导致乙烯能使酸性KMnO4溶液和溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向沸水中滴加饱和的氯化铁溶液制取胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 碳酸氢镁溶液中加入足量的氢氧化钠溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| C. | 硝酸铝溶液中加入过量的氨水:Al3++4NH3+2H2O═AlO2-+4NH4+ | |
| D. | 淀粉碘化钾试纸在潮湿空气中变蓝:4I-+O2+2H2O═2I2+4OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| ① | 硫酸溶液中加入Ba(OH)2溶液 | Ba2++SO42-═BaSO4↓ | 正确 |
| ② | 氧化铝与NaOH溶液反应 | 2Al3-+302-+20H- ═2AlO2-+H20 | 错误,Al203不应写成离子 形式 |
| ③ | 铁和足量稀硝酸反应 | Fe+2H+═H2↑+Fe2+ | 正确 |
| ④ | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | 错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
| A. | ① | B. | ①③ | C. | ②④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com