
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③④ | B. | ②④⑤ | C. | ①②⑤ | D. | ②③ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀硫酸中:K+、Mg2+、AlO2-、NO3- | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | $\frac{Kw}{c({H}^{+})}$=10-13 mol•L-1溶液中:Fe3+、NH4+、Mg2+、SO42- | |
| D. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+2H+═I2+2H2O | |
| B. | 电解氯化镁溶液产生黄绿色气体:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 将切开的金属Na露置在空气中,表面由光亮逐渐变暗:2Na+O2═Na2O2 | |
| D. | 向Ca(HCO3)2溶液中加入过量的烧碱溶液,出现白色沉淀:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数.图中:①空气 ②某溶液 ③纯碱 ④某溶液 ⑤碱石灰
纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数.图中:①空气 ②某溶液 ③纯碱 ④某溶液 ⑤碱石灰 ;装置C的作用是吸收生成的二氧化碳气体中的水蒸气;如果撤去装置C,则会导致测定结果偏高(填“偏大”、“偏小”或“不变”)
;装置C的作用是吸收生成的二氧化碳气体中的水蒸气;如果撤去装置C,则会导致测定结果偏高(填“偏大”、“偏小”或“不变”)查看答案和解析>>
科目: 来源: 题型:解答题
 A~F都是中学化学常见物质,它们间的相互转化关系如图所示,其中A、D、F是化合物,E是非金属单质.
A~F都是中学化学常见物质,它们间的相互转化关系如图所示,其中A、D、F是化合物,E是非金属单质. .
.查看答案和解析>>
科目: 来源: 题型:解答题

 B
B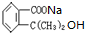
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +nH2O;反应类型:缩聚反应
+nH2O;反应类型:缩聚反应 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;反应类型:消去反应
+H2O;反应类型:消去反应 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ ;反应类型:加聚反应.
;反应类型:加聚反应.查看答案和解析>>
科目: 来源: 题型:解答题
 乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.
乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.| 温度(℃) | 乙醇转化率(%) | 有机产物含量(体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 125 | 20 | 8.7 | 90.2 |
| 150 | 68 | 16.7 | 82.2 |
| 175 | 88 | 32.3 | 66.8 |
| 200 | 90 | 86.9 | 12.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com