
科目: 来源: 题型:解答题
 .若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯,结构简式是(CH3)3C-CH=CH2.比烃A少两个碳原子且能使溴水褪色的A的同系物有3种同分异构体.
.若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯,结构简式是(CH3)3C-CH=CH2.比烃A少两个碳原子且能使溴水褪色的A的同系物有3种同分异构体.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | b、d、e | B. | b、c、e、f | C. | a、b、c | D. | b、c、d、e |
查看答案和解析>>
科目: 来源: 题型:解答题
 孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 某温度下,CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,相同浓度的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | NH4HCO3溶液中加入过量氢氧化钠溶液:NH4++OH-═NH3.H2O | |
| C. | AlCl3溶液中滴加过量氨水:Al3++3NH3.H2O═3NH4++Al(OH)3↓ | |
| D. | 磁性氧化铁(Fe3O4)溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 装饰材料释放的甲醛会造成污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可通过酸性高锰酸钾溶液来区别乙烷和乙炔 | |
| B. | 乙烯是石油裂解后的产物 | |
| C. | 石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化 | |
| D. | 棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
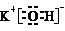 ;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.
;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.查看答案和解析>>
科目: 来源: 题型:解答题
 据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com