
科目: 来源: 题型:解答题
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
科目: 来源: 题型:解答题
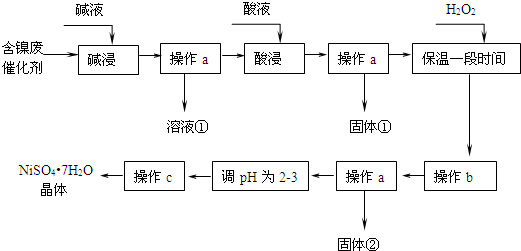
 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,不能(填“能”或“不能”确定产物中铁元素的价态. |
步骤2:取少量溶液,滴加酸性KMn4溶液 | 若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素,若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 |
| 步骤3:另取少量溶液,滴加KSCN溶液 | 若溶液变为血红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素. |
查看答案和解析>>
科目: 来源: 题型:解答题
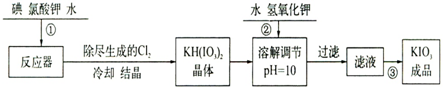
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,甲3mL水配制溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol.L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1滴1mol.L-1的H2SO4,从发振荡 | 溶液变蓝色 |
查看答案和解析>>
科目: 来源: 题型:填空题

| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目: 来源: 题型:填空题

 ;
;查看答案和解析>>
科目: 来源: 题型:解答题

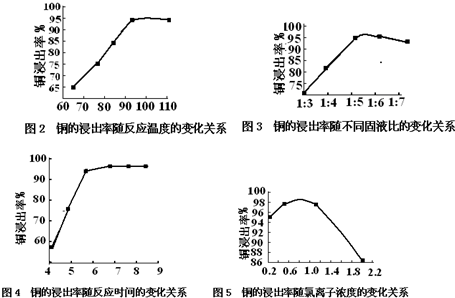
| 反应温度/℃ | 固液比 | c(Cl-)/mol•L-1 | 反应时间/h | |
| A | 95 | 1:5.5 | 0.8 | 6 |
| B | 100 | 1:5.5 | 0.7 | 7 |
| C | 110 | 1:6 | 0.9 | 8 |
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com